手机版 欢迎访问云霄霄(www.wx10.com)网站
近年来,日本的药用化妆品在亚洲乃至全球市场中一直占有重要位置。日本药用化妆品产业蓬勃发展、品类齐全,是作为医药部外品分类管理的一类具有杀菌、美白、祛斑、除臭等功效的产品,具有市场广阔、品牌辨识度高、分类明确、监管全面等特点。日本的药用化妆品实行审批制管理,产品从生产、流通到售后各环节都有监管部门依据相关法规进行全流程规范管理。其中,尤以包含企业责任审批、产品有效性·安全性审批、产品生产方法·管理体制审批三个类别的综合审批体系最具有代表性。此外,完善的原料管理和副作用报告制度也具有借鉴意义。
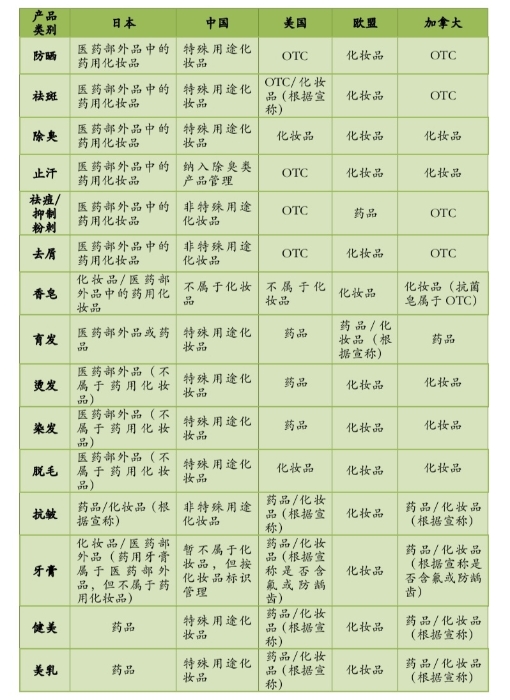
在日本,化妆品分为两大类,一类是普通化妆品,指为了清洁、美化,或者使皮肤或毛发保持健康状态,采用涂、擦、喷、洒或类似方式用于身体各部分,且只包含对人体作用温和的物质,类似于我国所称的普通化妆品,包括清洗产品、头发养护产品、化妆产品、香水、美甲产品、眼线类产品、唇用产品、口腔类产品(口腔清洗,非口腔消毒)和洗浴产品等;另一类被称为药用化妆品(日语:薬用化粧品),类似于我国的特殊用途化妆品,包括药用化妆水、药用乳液、药用乳霜、药用洗发水、药用护发素、药用皂6大类,在分类监管上被归为医药部外品,由厚生劳动省依据《药事法》[]相关规定进行研发、制造、销售和售后监管。

日本法律明确规定药用化妆品的目的是“预防”,而非“治疗”,没有医疗功效,但含有日本厚生劳动省认可(经实验证明且申请被批准)的药理作用成分,日语称为“有効成分”,具有可期待的效果,如杀菌、抗菌、美白、祛斑、除臭等功效。例如,普通化妆品加入了厚生劳动省认定的美白有效成分维他命C(即抗坏血酸,アスコルビン酸),并进行了效果实验和定量验证,就可以申请获批,厚生劳动省对“有效成分”的使用配比也有一定限制,如维他命C的配比标准为3%-5%。
延展阅读:药用化妆品在不同国家和地区的分类管理比较
一、产业概况
日本的化妆品产业非常发达,销售额从2012年开始持续保持增长趋势,2015年后日本化妆品出口额一直远超进口额,其中中国位列日本化妆品出口国的第一,日本的药用化妆品在日本化妆品生产金额中比重达24%,并且近年来呈现不断增长。
2018年,日本药用化妆品年销售额为4352亿日元(共18956个品种),相当于药用化妆品人均年消费水平为3454日元。
日本药用化妆品产品多出自大中型化妆品生产企业,小部分为制药企业生产。生产药用化妆品的主要化妆品企业有资生堂(SHISEIDO)、花王(KAO)、高丝(KOSE)等,主要药企有乐敦(ROHTO)、日邦药品工业(REBAKORU)等。
2018年,日本医药部外品出口额为434亿日元,进口额为614亿日元,其中药用化妆品出口额为400亿日元,进口额为264亿日元。
2018年日本药用化妆品产销综合统计
为什么日本能产生如此众多的全球知名化妆品品牌,成为亚洲乃至全球化妆品市场的代表?为什么日本药用化妆品能够成为与欧美比肩的全球两大药用化妆品代表体系之一?其中的关键离不开品牌意识与技术创新、流通战略和经营模式等因素。
(一)品牌意识与技术创新
“专业、品质、精准”是人们对日本品牌的印象。日本企业特别重视产品的质量,视质量为品牌的生命。日本化妆品品牌非常专注研究消费者的消费习惯、需求点及消费心理,然后针对性地进行产品技术研发。相比较欧美对小麦肤色的追求,亚洲人更注重对美白的要求。因此纵观日本各大化妆品企业,具有美白功效的药用化妆品都稳居拳头产品位置。以多年蝉联日本Cosme排行榜第一的资生堂HAKU产品为例,该产品2005年一经上市就引起轰动,凝结着资生堂最新的美白技术,主打两个美白成分——m-氨甲环酸(传明酸)和4MSK(4甲基水杨酸钾盐),是资生堂花费多年研发的革命性成果,只有资生堂可以把这2个成分用在同一个配方里,该配方也在多国申请了专利注册,且不断进行创新和升级。
(二)流通战略和经营模式
在日本,大品牌化妆品企业特别重视化妆品终端销售。以资生堂为例,品牌成立之初一度采取一般销售模式,很难维护产品从批发到零售的定价秩序,导致产品被廉价出售,一直专注于中高级产品的资生堂曾一度险些陷入倒闭的绝境。之后,资生堂开创性地将销售公司引入商品销售过程,采取制度品流通销售模式,不同于多出现在超级市场和便利店的一般销售模式,该模式通过“生产商—销售公司—代理商—消费者”进行销售,代理商要经营出售资生堂产品,必须和销售公司结成契约关系,在一定区域内,代理商负责给规定的零售连锁店提供资生堂产品,同时还需向资生堂支付一定的保证金,以确保代理商不向契约外的零售店提供产品货源,这样资生堂就和销售公司共同主导控制了商品的销售过程和价格。此外,资生堂还与零售商共同出资、规划、建设品牌专柜,由资生堂向专柜派遣培训过的专业美容店员,为消费者提供一对一的服务,生产商与零售商之间的关系非常紧密。如此高度重视产品的流通销售,使资生堂成为化妆品流通管理的成功典范,除了资生堂,花王等大品牌也多采取此种销售模式。
日本的药妆店模式
日本主要有4种药用化妆品品牌销售终端渠道:药妆店、便利店、百货店、专营店,其中药妆店模式最为典型。
日本药妆店英文为“DrugStore”,看似应译为“药店”,但与传统药店不同,这种药妆店将健康人群作为目标客户,彻底脱离了只有病患才可以到药店进行消费的传统认知。同时在其运营中,也注入了由医药、健康不断延伸的新理念:治疗、预防、卫生、健康和美容。店内陈列的产品也扩展为药品、化妆品、美容美发、保健食品、婴儿用品、卫生用品、日用杂货等。
日本第一家药妆店于1976年开业,经过40年的发展,经营范围已远远超出单纯“药店”范畴。根据日本药妆连锁店协会(JACDS)的连锁店销售统计显示,截至2019年6月,JACDS共有药妆店公司会员133个,拥有门店数20593家。JACDS规定,必须拥有11家店铺以上或年销售额达10亿日元以上的企业才能注册成为会员,因此统计具有代表性。

东京新宿三丁目的松本清药妆店
日本随处可见药妆店,一般店面都不大,却陈列着几千种化妆品,而且价格比专卖店低很多,备有充足的产品试用装,没有售货员或导购尾随,成为吸引消费者的重要原因。长于产品推广的日本药妆连锁店在新产品上市后会立即将产品摆放于店铺门口,卖不好的产品通常三个月就会消失,竞争激烈使日本药用化妆品市场发展迅速。
二、品类功能
日本药用化妆品有其自身存在和发展的坚实基础,主要原因包含两个方面,一方面消费者根据自己身体状态对于化妆品及药品中间地带的产品有客观需要,另一方面医生对于处理光敏性、痤疮等皮肤护理问题也有临床需要,二者结合促使药用化妆品拥有巨大的市场潜力。
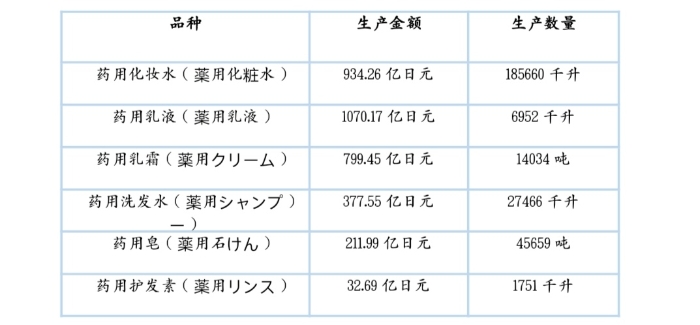
根据日本厚生劳动省网站显示,日本的药用化妆品主要包含6大类,2018年各品种产额见下表:
2108年日本药用化妆品生产分类统计
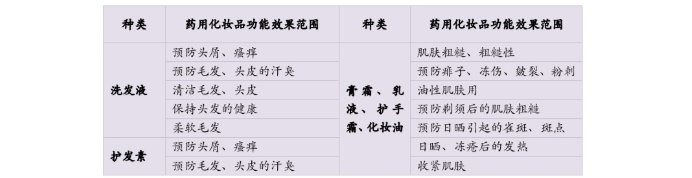
2011年,日本化妆品工业联合会(JCIA)对药用化妆品的具体功能做出以下整体规定:

三、监管法规
日本药用化妆品是归属于医药部外品分类管理的,所以对药用化妆品的规制都体现在医药部外品相关监管法规中。
日本最早与药用化妆品相关的法律规定是1877年公布的《药物销售规则》,其中第11条规定专门滋养用品、化妆水不属于药物管辖范围,并把这类产品与牙膏等产品统称为“药物销售外用品”。
1932年,日本颁布准成药管理规则,将医药部外品纳入准成药进行管理。规则中规定了准成药的定义以及销售者的许可制等,还规定有义务在外包装注明“准成药”。但在执行中,化妆品和医药部外品并未接受像药品那样的严格管理。
1943年的《药事法》首次把药物销售外用品称为医药部外品,但在1948年的修订中,又废除了医药部外品制度,药用化妆品或归化妆品管理,或归药品管理。
1960年新《药事法》重新对医药部外品进行了定义,并将原来的医药部外品的登记制改为许可制,同时规定生产医药部外品的企业中必须配备责任技术员。1976年日本实施了医药部外品的良好生产操作规范(GMP)。
2001年新《药事法》修订,规定并不要求医药部外品标明全部成分,只需标明指定成分,对其功能效果范围进行了规定。
2005年,日本将医药部外品制造销售行为从制造业中分离出来,建立了制造业许可制度和制造销售业许可制度,规定医药部外品的制造销售业者,必须进行医药部外品品质管理及制造销售后的安全管理,赋予了设立制造销售总负责人的义务,明确了医药部外品销售所需承担的责任,以及厚生劳动大臣的医药部外品销售管辖范围,构建了不以拥有制造厂为前提的行业准入制度。
日本药用化妆品监管法规及负责部门

四、监管要点
(一)准入制度
日本有关药用化妆品的审批体系主要包括企业责任审批、产品有效性?安全性审批、产品生产方法?管理体制审批三大类,企业需提出相关申请,主管机构按照规定进行综合判断审核,得到批准后企业才可以开展药用化妆品研发、制造、上市销售等行为。
日本药用化妆品研发、制造、销售审批体系

1.制造销售业许可审批
2005年4月1日,日本修订实施的《药事法》将医药部外品生产企业细分为制造业和制造销售业来管理,实施医药部外品制造销售业许可审批制。如此划分的目的是强化产品上市后的安全管理,把产品的责任放在与消费者较近的地方,管理模式向欧美靠拢。企业要进行药用化妆品制造销售,就要申请医药部外品制造销售业许可,该许可由各都道府县首长签发,审批事项包括企业名称、地址、许可类型、制造销售负责人及地址、企业违规历史概况、企业是否获得过其他制造销售业许可概况等。
《药事法》规定企业责任者对产品质量安全负有责任,如发生重大事故责任者将被追究刑事责任,面临3年以下刑罚,并处以200万日元的罚款,另外企业还要负责产品召回、赔偿,并进行公开道歉,情节严重者将被吊销生产销售许可。
2.产品制造销售承认审批
该审批是针对具体的产品进行的审批,药用化妆品产品审批依据医药部外品相关规定。申请者不用提供全部资料,而是根据产品类别、是否包含新的有效成分、是否是已通过审批的产品突破了已有使用标准等具体情况,提供申报资料(除了药用化妆品,医药部外品中的其他产品比如染发剂、烫发剂、药用牙膏和药用沐浴液有单独的产品标准,包括有效成分、添加剂的种类和含量、规格等)。如果包含新的成分,申请时要提交成分配方安全性、有效性、稳定性和使用情况等方面的资料。
审批内容包括产品销售名称、成分及含量或本质(配方成分的名称、含量、规格及调配目的)、制造工艺、用法及用量、功能或效果、储藏方法及有效期、产品规格及试验方法、制造销售企业名称地址及已获得的许可类型及证号等。
提出申请的药用化妆品产品能否被批准为医药部外品,前提是每个产品的使用目的是否在药事法规定的范围内,要根据其成分、含量、功能、效果、用法、用量、剂型等综合判断。其中对于药用化妆品有效成分审查的标准主要依据是2008年日本厚生劳动省医药食品局发布的药食审查发第1225001号文件《药用化妆品有效成分列表》(《いわゆる薬用化粧品中の有効成分リストについて》),该文件中详细规定了药用化妆品各个品类所包含有效成分的名称、规格等具体标准,其中的规格标准主要是依据《日本药局方》、《2002年日本药局方外医药品规格》、《2006年医药部外品原料规格》来确定的。
产品制造销售承认审批需要6个月,承认审核由综合机构负责,之后的GMP适应性调查审批由行政机关负责(详见4.GMP适应性调查审批),药用化妆品最终由厚生省大臣批准,医药部外品的其他一部分产品只需要地方知事批准。
3.制造业许可审批
指由药用化妆品生产企业向地方政府申请生产许可,该许可只是允许进行制造行为,不得进行销售行为,而且每5年必须进行许可的更新。审批内容包括企业名称、地址、许可类型、生产条件概要、企业负责人、企业违规历史概况、企业是否获得过其他制造业许可概况等。具体申请材料还包括工厂周边及平面图、制造设备器具一览表、实验检查设备器具一览表、相关人员履历等,审批依据的标准包括质量管理标准(GQP)和制造售后安全管理标准(GVP)等。制造业许可审核包括书面审核和实地审核两种程序,审核主体为行政机关,许可批准需要6个月时间。
4.GMP适应性调查审批等
除了制造业许可审批,关于产品生产方法和管理体制的审批还包括GMP适应性调查审批和外国制造业认定审批。前面提到的产品制造销售承认审批必须通过GMP适应性调查审批,GMP适应性调查审批包括书面审核和实地审核,审核主体为行政机关。外国制造业认定审批则与制造业许可审批类似。
(二)原料管理
相关规定除了前面提到的《药用化妆品有效成分列表》外,还包括厚生劳动省公布的《医药部外品可用原料名单》,该名单是由日本化妆品工业联合会提出,由厚生劳动省确定的,包括了医药部外品可以使用的有效成分和添加剂(有效成分之外的其他成分为添加剂)名单及使用规格,对于生产医药部外品所用成分,此名单之外的为新原料。厚生劳动省还有一份未公开公布的“医药部外品可用原料名单”,该名单是由企业自主申请并获得批准的,出于产权保护的考虑,此名单未公开,名单中的原料对于原料申报企业而言不是新原料,但对于其他企业属于新原料。
日本厚生劳动省对新原料实行严格的审批制度。企业申报新原料时要提供使用背景、理化性质、安全性和稳定性方面的资料。需要指出的是,被批准不仅只是原料物质本身,还包括它的使用范围,用量和使用规格等,在被用于生产化妆品或医药部外品时必须符合这些内容,如有突破必须重新申报。
(三)标识管理
从“美白、祛斑、祛黑头”到“防晒、抗痘、天然成分”,日本药用化妆品的功效被代购的商家越夸越大。但事实上,日本对药用化妆品的功效宣传管理非常严格,对于每一种产品基本上都固定了宣传用语。在产品审核过程中,负责技术咨询的机构可以就功效的确定和标识等问题同企业直接讨论。
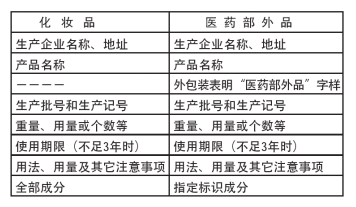
日本药用化妆品的外包装需明确标有“医药部外品”字样,不要求标注所有成分,由厚生劳动省来指定必须标识的成分(主要指可能引起副作用的成分等情况),其余成分的标识由企业自愿选择。所标成分的日语译名由日本化妆品工业联合会确定。
药用化妆品容器标签须标注的内容如下:①持有许可证的生产商和经销商名称和地址;②指定的医药部外品名称;③通用名称(如果接受);④生产厂商号码或代码;⑤内容量:用质量、容量、数量等表示;⑥官方指定的须标注的医药部外品成分名称;⑦官方指定的医药部外品成分的有效期;⑧相关标准要求在直接容器或包装上标注的医药部外品成分的性质、质量、性能等;⑨法律规定的其他项目。
部分药用化妆品,比如包含曾引起副作用的有效成分的产品或者需要进行使用提示的产品,应标示使用注意事项或警示用语,如防晒霜应标示“本品请每2~3小时重新涂抹”或“用毛巾擦拭过肌肤后,请重新涂抹”。
(四)售后监管
1.副作用报告制度
2014年,日本针对《药事法实施规则》及《药品、医药部外品、化妆品和医疗器械制造销售后安全管理标准省令》进行修订,开始实施新的副作用报告制度,修订前化妆品制造销售商只需要提交产品研究报告,并没有对由产品引起的副作用进行报告的义务。
新的副作用报告制度明确规定制造销售商要从医疗相关人员或机构处收集医药部外品使用安全信息,并开展副作用调查研究,在产品引起严重副作用时必须在规定的报告期限内向厚生劳动省管辖的独立行政法人医药品医疗器械综合机构(PMDA)进行副作用报告。如果在规定的报告期限内无法完成副作用调查的话,必须要在报告期限内先提交当前的调查结果,并且注明调查完成所需时间和理由。之后厚生劳动省根据副作用报告发布警示通知,必要时要求制造商在产品包装上标识警示用语。
所谓不良反应,是指医药部外品的医学调查研究试验中显示该产品包含成分发生了或可能发生有害作用,如引发癌症、过敏症、皮肤障碍等,而且该有害作用中,包含怀疑因医药部外品的使用而造成的感染症。
药用化妆品副作用报告权限
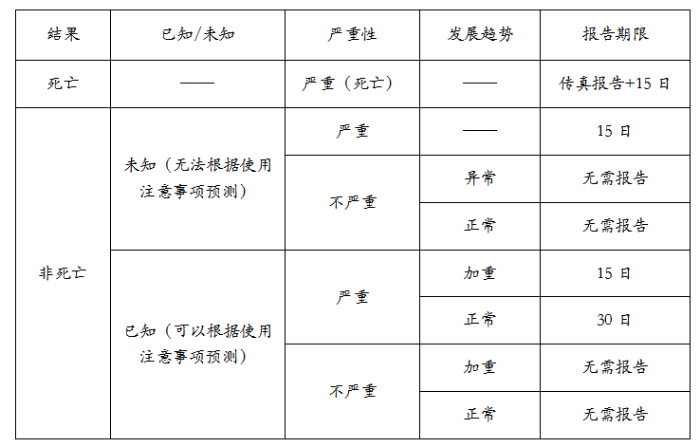
注:非死亡严重副作用包括①死亡;②残疾;③有可能引起死亡的不良反应;④有可能引起残疾的不良反应;⑤需要入院治疗;⑥上述以外的严重不良反应;⑦慢性疾病或下一代的异常症状;⑧至少需要30天方能治愈的不良反应。
(作者单位:国家图书馆)